 Los anticuerpos monoclonales (mAbs) han demostrado un éxito considerable para la terapéutica del cáncer.
Los anticuerpos monoclonales (mAbs) han demostrado un éxito considerable para la terapéutica del cáncer.
El número de mAbs contra el cáncer en el uso clínico o bajo investigación se ha incrementado dramáticamente en los últimos años. Sin embargo, aún queda mucho margen de mejora. Los anticuerpos terapéuticos actúan principalmente dirigiéndose directamente a las células tumorales o dirigiéndose a las células inmunes en el microambiente tumoral. Su capacidad para inducir la regresión del tumor depende de su naturaleza bifuncional: el fragmento de unión al antígeno (Fab) confiere una especificidad del antígeno, mientras que el fragmento constante (Fc) desencadena funciones efectoras de anticuerpos dependientes mediante la participación de una variedad de receptores de Fc (FcRs). Estas funciones efectoras incluyen la citotoxicidad y la fagocitosis celular dependiente de anticuerpos (ADCC y ADCP) y complementan la citotoxicidad dependiente (CDC), que se puede combinar para facilitar el exterminio mediado por anticuerpos de células tumorales
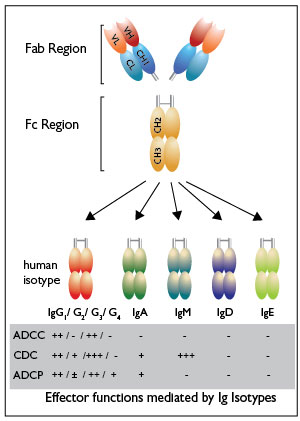
Los anticuerpos clínicos son de la clase IgG, la cual está dividida en cuatro isotipos: IgG1, IgG2, IgG3 e IgG4. La región Fc de estos cuatro isotipos IgG humanos se unen a los FcgRs, con diferente afinidad y especificidad. Los FcgRs están localizados en la superficie de las células inmunes efectoras (células asesinas naturales, neutrófilos, macrófagos / monocitos) y están ya sea activando (Fc GRI, FcgRIIA, FcgRIIIA) o inhibiendo (FcgRIIb). Los IgG2 y IgG4 interactúan escasamente con los FcgRs y presentan funciones efectoras débiles, mientras que el IgG1 y el IgG3 interactúan más fuertemente con FcgRs y, por tanto, median funciones efectoras potentes. En particular, el IgG1 es el isotipo más utilizado para mAbs contra el cáncer, al igual que es el isotipo IgG más eficaz en la mediación de las ADCC. Las afinidades de union IgG Fc-FcgR están determinadas por las secuencias de aminoácidos de los diferentes isotipos IgG Fc y los patrones N-conectados de glicano de los dominios IgG Fc. Por lo tanto, las funciones efectoras mediadas por anticuerpos de un anticuerpo dado se pueden modular mediante la ingeniería de su dominio IgG Fc para modificar el compromiso de los FcgRs seleccionados.
Los mAbs terapéuticos que se dirigen a los antígenos en la superficie de células malignas, tales como rituximab (anti-CD20), trastuzumab (anti-HER2) y cetuximab (anti-EGFR), funcionan en gran medida a través de mecanismos inmuno-mediados, incluyendo ADCC y ADCP1. Por lo tanto, una estrategia para mejorar la eficacia de los mAbs contra el cáncer es aumentar estas funciones efectoras por la ingeniería del dominio IgG1 Fc. Esto se puede lograr cambiando la secuencia de aminoácidos para aumentar la interacción del dominio Fc con FcgRIIIA (CD16), como en el caso de ocaratuzumab, un anti-CD20 mAb2. Además, la modificación de hidratos de carbono específicos, tales como la fucosilación disminuida del glicano Fc de los anticuerpos de IgG1, conduce a una mayor afinidad por CD16 y, por consiguiente, a una mayor inducción de ADCC / ADCP. Ejemplos de tales anticuerpos fucosilados incluyen obinutuzumab (GA101), un anticuerpo anti-CD20 actualmente en ensayos clínicos, y imgatuzumab (GA201), un anticuerpo anti-EGFR bajo investigación. Además de los anticuerpos IgG1, otros isotipos inducen ADCC / ADCP, tales como los anticuerpos IgA, que contribuyen de manera significativa a la parte humoral del sistema inmune de la mucosa. Estudios que exploran su potencial han sido reportados, revelando interesantes propiedades de anticuerpos IgA.
Durante la última década, los mAb que interfieren con las vías de regulación de las células T han sido desarrollados y están generando un considerable entusiasmo. Estos mAbs, llamados anticuerpos de bloqueo de punto de control, se dirigen a moléculas reguladoras, tales como CTLA4 (por ejemplo ipilimumab) y PD1 (por ejemplo nivolumab) o su ligando PD-L1 (por ejemplo atezolizumab), de los cuales todos están expresados por células inmunes. Nivolumab, originalmente un anticuerpo IgG1, es un mAb terapéutico diseñado con un dominio IgG4 Fc para reducir las funciones efectoras inmunes. Atezolizumab es también un mAb diseñado por la introducción de una mutación en el dominio de IgG1 Fc con el fin de abolir sus funciones efectoras.
Ahora está claro que diseñar los dominios Fc para optimizar o reducir sus interacciones con los FcgRs dará lugar a anticuerpos terapéuticos con actividades antitumorales mejoradas.
 Para ayudarle a decidir qué isotipo Ig es el más adecuado para su aplicación, InvivoGen proporciona anticuerpos monoclonales clínicamente relevantes, tales como anti-hCD20 (rituximab), anti-HER2 (trastuzumab) y anti-hTNF-α (adalimumab). Estas familias isotipo de anticuerpos le ayudará a estudiar las funciones efectoras entre diferentes isotipos (o entre el mismo isotipo de dos especies diferentes).
Para ayudarle a decidir qué isotipo Ig es el más adecuado para su aplicación, InvivoGen proporciona anticuerpos monoclonales clínicamente relevantes, tales como anti-hCD20 (rituximab), anti-HER2 (trastuzumab) y anti-hTNF-α (adalimumab). Estas familias isotipo de anticuerpos le ayudará a estudiar las funciones efectoras entre diferentes isotipos (o entre el mismo isotipo de dos especies diferentes).
– El IgG1 humano: el isotipo preferido para los anticuerpos antitumorales:
El IgG1 es el isotipo Ig más abundante en el suero humano. El IgG1Abs humano, conduce a altos niveles de ADCC, ADCP y CDC induciendo la muerte de células bombardeadas.
– El IgG4 humano (S228P): el isotipo preferido para anticuerpos inmunomoduladores:
Los IgG4Abs Humanos muestran ADCC, ADCP reducidos y no CDC. Estas moléculasse experimentan un proceso conocido como intercambio de brazo Fab que reduce potencialmente su eficacia terapéutica. El IgG4 (S228) contiene una región mutada dependiente diseñada (S228P) diseñada para prevenir el intercambio de moléculas de IgG4.
– El IgA2 humano: un isotipo alternativa para la terapia de anticuerpos:
El IgA es el segundo isotipo Ig más abundante en la circulación humana y el más prevalente en las secreciones mucosas. Los IgA Abs se unen al receptor FcαRI (CD89), lo que desencadena un ADCC mediado por neutrófilos y un ADCP mediada por macrófagos.
